当前位置:
悬浮液的分散稳定性
悬浮液中固体粒子比表面积大,表面自由能也大,容易在范德华引力的作用下,相互合并而发生絮凝或聚结,其中絮凝结构松散,摇晃后粒子可重新分散,而聚结结构紧密,摇晃后不会再分散。此外,粒度大小不一的固体粒子因在液体介质中溶解度不同而导致奥氏熟化现象,即小质点不断消失,大质点逐渐增多,表现为晶体长大现象。在实际应用中,通过添加合适的分散剂可以显著提高悬浮液的分散稳定性,分散剂通常为表面活性剂,也有部分高分子聚合物。分散剂分子吸附在固体粒子周围,通过静电斥力、空间位
阻以及形成溶剂化链等作用来维持悬浮液的分散稳定性。
阻以及形成溶剂化链等作用来维持悬浮液的分散稳定性。
悬浮液中固体粒子比表面积大,表面自由能也大,容易在范德华引力的作用下,相互合并而发生絮凝或聚结,其中絮凝结构松散,摇晃后粒子可重新分散,而聚结结构紧密,摇晃后不会再分散。此外,粒度大小不一的固体粒子因在液体介质中溶解度不同而导致奥氏熟化现象,即小质点不断消失,大质点逐渐增多,表现为晶体长大现象。在实际应用中,通过添加合适的分散剂可以显著提高悬浮液的分散稳定性,分散剂通常为表面活性剂,也有部分高分子聚合物。分散剂分子吸附在固体粒子周围,通过静电斥力、空间位
阻以及形成溶剂化链等作用来维持悬浮液的分散稳定性。
1) 静电斥力。磺酸盐类、磷酸酯盐类和羧酸盐类等阴离子型分散剂,能够在水中电离出带有负电荷的亲水基团,固体粒子表面通过吸附阴离子型的分散剂而形成Zeta 电位,带有同种净电荷的粒子相互排斥,阻止其相互团聚,从而保持分散状态。Zeta 电位越大,静电斥力越大,粒子间越不容易靠近,分散稳定性越好。由于电解质离子和介质pH 可以影响到分散剂分子在水中的电离程度,所以这些因素的存在都会影响到阴离子型分散剂静电斥力的强弱。
2) 空间位阻。非离子型分散剂的疏水链吸附在固体粒子表面,亲水链则伸入水介质中,当固体粒子间相互靠近时,亲水链遭受叠加或压缩而通过降低构型熵产生很强的排斥力,相当于在粒子周围形成“围墙”,提供有效的空间位阻作用,几乎不受电解质离子的影响。为了获得较好的空间位阻作用,分散剂分子应强力吸附于粒子表面,且充分覆盖,无裸露,亲水链段有足够的长度和舒展度。
3) 溶剂化作用。分散剂分子中的亲水性侧链在
介质水中充分伸展,在固体粒子表面形成一定厚度的保护层,阻止其相互靠近,被称为溶剂化作用溶剂化链与分散介质间的相容性以及溶剂化链的长度均会影响溶剂化作用的强弱。其中溶剂化链的长度要适中,溶剂化链太短,立体屏障作用不明显,不能有效避免固体粒子间的团聚或絮凝。溶剂化链太长,分散剂分子对介质水的亲和力过高,容易从粒子表面解吸附,不能发挥其分散稳定作用。
悬浮液的悬浮稳定性
在悬浮液中,固体粒子由于受到重力作用而发生沉降,由斯托克斯公式可知[23],固体粒子粒径越大,固体粒子与液体介质间的密度差越大,且液体介质黏度越小,则粒子沉降越快。斯托克斯公式见下:
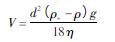
式中d 为固体粒子直径,cm; ρs为固体粒子密度,g /cm3 ; ρ 为液体介质密度,g /cm3 ; g 为重力加速度,cm/s2 ; η 为液体介质黏度,mPa·s。在实际应用中,通过添加合适的增稠剂或触变剂来提高悬浮液的悬浮稳定性。增稠剂或触变剂主要为黄原胶[24]、阿拉伯胶等多糖类物质和硅酸镁铝等无机化合物,通过增加体系黏度或形成网状的触变结构从而阻止固体粒子的沉降.
阻以及形成溶剂化链等作用来维持悬浮液的分散稳定性。
1) 静电斥力。磺酸盐类、磷酸酯盐类和羧酸盐类等阴离子型分散剂,能够在水中电离出带有负电荷的亲水基团,固体粒子表面通过吸附阴离子型的分散剂而形成Zeta 电位,带有同种净电荷的粒子相互排斥,阻止其相互团聚,从而保持分散状态。Zeta 电位越大,静电斥力越大,粒子间越不容易靠近,分散稳定性越好。由于电解质离子和介质pH 可以影响到分散剂分子在水中的电离程度,所以这些因素的存在都会影响到阴离子型分散剂静电斥力的强弱。
2) 空间位阻。非离子型分散剂的疏水链吸附在固体粒子表面,亲水链则伸入水介质中,当固体粒子间相互靠近时,亲水链遭受叠加或压缩而通过降低构型熵产生很强的排斥力,相当于在粒子周围形成“围墙”,提供有效的空间位阻作用,几乎不受电解质离子的影响。为了获得较好的空间位阻作用,分散剂分子应强力吸附于粒子表面,且充分覆盖,无裸露,亲水链段有足够的长度和舒展度。
3) 溶剂化作用。分散剂分子中的亲水性侧链在
介质水中充分伸展,在固体粒子表面形成一定厚度的保护层,阻止其相互靠近,被称为溶剂化作用溶剂化链与分散介质间的相容性以及溶剂化链的长度均会影响溶剂化作用的强弱。其中溶剂化链的长度要适中,溶剂化链太短,立体屏障作用不明显,不能有效避免固体粒子间的团聚或絮凝。溶剂化链太长,分散剂分子对介质水的亲和力过高,容易从粒子表面解吸附,不能发挥其分散稳定作用。
悬浮液的悬浮稳定性
在悬浮液中,固体粒子由于受到重力作用而发生沉降,由斯托克斯公式可知[23],固体粒子粒径越大,固体粒子与液体介质间的密度差越大,且液体介质黏度越小,则粒子沉降越快。斯托克斯公式见下:
式中d 为固体粒子直径,cm; ρs为固体粒子密度,g /cm3 ; ρ 为液体介质密度,g /cm3 ; g 为重力加速度,cm/s2 ; η 为液体介质黏度,mPa·s。在实际应用中,通过添加合适的增稠剂或触变剂来提高悬浮液的悬浮稳定性。增稠剂或触变剂主要为黄原胶[24]、阿拉伯胶等多糖类物质和硅酸镁铝等无机化合物,通过增加体系黏度或形成网状的触变结构从而阻止固体粒子的沉降.




